La dilatación térmica es el aumento de volumen que experimenta un cuerpo material cuando se eleva tu temperatura. Afecta a todos los estados de agregación de la materia.
- Dilatación en sólidos
- Dilatación lineal: variación de la longitud que tiene lugar cuando una dimensión predomina sobre el resto, como en un hilo, una barra o un alambre:
- l = l0 . (1 + λ . ΔT)
- donde el coeficiente de dilatación lineal, , es un parámetro característico de cada material, que se mide en k-1o ºC-1 ; l0 es la longitud inicial; l, la final, y ΔT=T-T0, la variación de temperatura.
- Dilatación superficial: si una dimensión es mucho menor que las otras dos, como en láminas y planchas, se mide la variación de su área:
-
S = S0 . (1 + σ . ΔT)
- Dilatación cúbica: todas las dimensiones son similares:
-
V = V0 . (1 + φ . ΔT)
- Los coeficientes de dilatación superficial y cúbica, 1 y 1, se calculan a partir de 1, el coeficiente de dilatación lineal:
-
σ = 2 . φ
-
φ = 3. λ
- Dilatación en líquidos
- Es similar a la dilatación cúbica en solidos. Si 1 es el coeficiente de dilatación del líquido, resulta:
-
V = V0 . (1 + β . ΔT)
- Dilatación en gases
- El volumen de un gas varía tanto con la presión como con la temperatura. Para medir los cambios de volumen debidos a variaciones de temperatura, mantenemos constante la presión:
- donde βp vale igual para todos los gases: βp =1/273,15 ºC-1
2. Efectos y propagación del calor
- Capacidad calorífica y calor específico
La relación entre la variación de temperatura, ΔT, y el calor intercambiado, Q, viene dada por la ecuación fundamental de la termología:
Q = C . ΔT
C es la capacidad calorífica del cuerpo. La capacidad calórica de un cuerpo es la cantidad de calor que tiene que intercambiar para que su temperatura varíe 1 kelvin. Se mide en J . K-1o J. ºC-1. Cuando el cuerpo está formado por una única sustancia, se utiliza la magnitud física llamada calor específico.
El calor específico , c, es la cantidad de calor que tiene que recibir la unidad de masa de esa sustancia para que su temperatura aumente 1 kelvin.
Q = m. c. ΔT
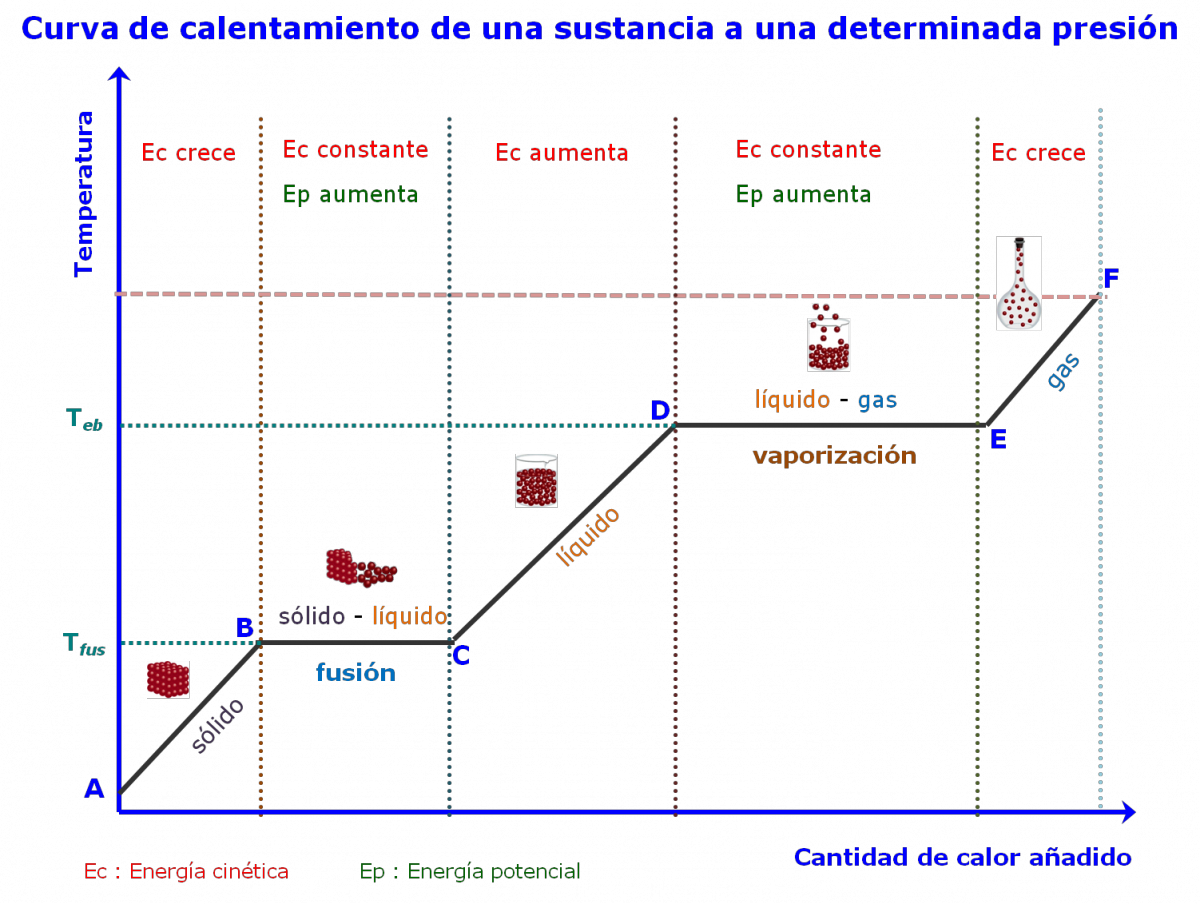
- Cambios de estado de agregación
La característica térmica fundamental de los cambios de estado es que ocurren a temperatura constante, porque todo el calor ganado o perdido por el cuerpo se consume en dicho cambio.
En los cambios de estado interviene una cantidad de calor característica de cada sustancia llamada calor latente, L, o variación de entalpía.
Así, la fusión de 1 kg de hielo a 0ºC y 1 atm consume 335 kJ. Por tanto, Lfusión =335 kJ/kg es el calor latente de fusión del hielo. Como L se refiere a la unidad de masa, el calor global de un cambio de estado será: Q = m .L
- Propagación del calor
- Conducción. Se produce entre cuerpos en contacto o partes de un mismo cuerpo a distinta temperatura. Se basa en la transferencia directa de energía cinética a escala atómico-molecular.
- Convección. Precisa materia en forma fluida (gas o líquido). El calor se propaga por corrientes de convección. Es mucho más eficaz que la conducción.
- Radiación. No requiere presencia de una conexión material. Así llega a la Tierra la energía solar tras cruzarse el espacio vacío intermedio. Todos los cuerpos materiales emiten radiación térmica. Su naturaleza es electromagnética, como la luz, pero en general fuera de la zona visible del espectro. Solo cuerpos muy calientes como el Sol o el filamento de una bombilla emiten radiación visible a nuestros ojos. A temperaturas más bajas, la emisión es radiación infrarroja, no visible, pero que nos produce sensación de calor.